联系电话:13162931356
固定电话:0571-89925175
公司地址:杭州市西湖区金蓬街366号2号楼506,512室

2019年2月12日,浙江大学医学院基础医学系,免疫学研究所蔡志坚教授/王建莉教授课题组在《Immunity》在线发表了最新研究成果“Specific Decrease in B Cell-Derived Extracellular Vesicles Enhances Post-Chemotherapeutic CD8+ T Cell Responses”。该工作充分揭示了化疗后系统性免疫抑制的新机制,为临床上提高肿瘤的化疗效果提供了新思路。
化疗是目前治疗癌症最有效的手段之一,和手术、放疗一起并称癌症的三大治疗手段。然而,化疗长期以来一直与诱导全身性免疫抑制有关。许多化疗药物是骨髓抑制剂,可以抑制骨髓中血细胞的产生,减少绝对白细胞计数,导致淋巴细胞减少。肿瘤特异的CD8阳性T细胞是清除化疗抵抗或化疗后残余肿瘤细胞的最主要效应细胞,能有效防止化疗后肿瘤的复发。但是,化疗伴随的系统性免疫抑制极大程度上限制了肿瘤特异的CD8阳性T细胞的活化,最终导致化疗的失败,肿瘤复发并快速进展。因此,充分阐明化疗后系统性免疫抑制的机制,对提高化疗效果,防止肿瘤复发具有关键意义。
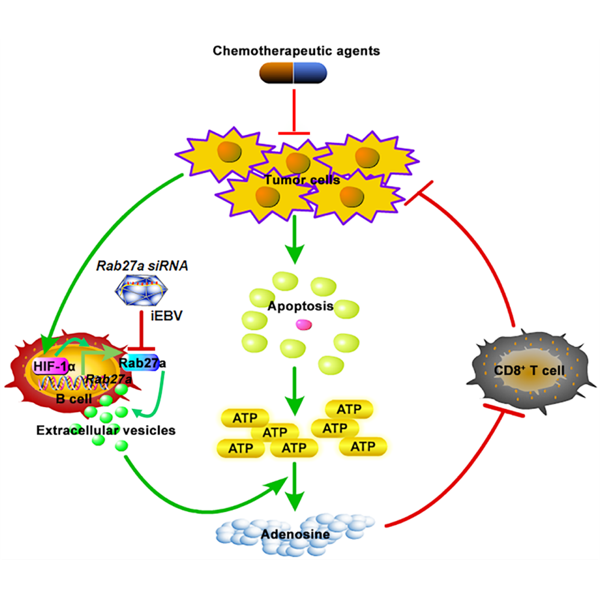
化疗药物诱导的凋亡肿瘤细胞可在短时间内向胞外释放大量的ATP,人体如何处理这样巨大水平的ATP及其对机体抗肿瘤免疫的影响仍不清楚。CD39是外核苷三磷酸二磷酸水解酶1,可将ATP水解为ADP或AMP。 CD73是5-主核苷酸水解酶,可将AMP水解为腺苷。腺苷是一种功能强大的免疫抑制性分子,能够抑制CD8阳性T细胞的活化。该研究发现,B细胞释放的CD19阳性胞外囊泡含有高水平的CD39和CD73分子,能将化疗药物诱导的凋亡肿瘤细胞释放的ATP水解为腺苷,抑制化疗后CD8阳性T细胞的活化,进而削弱化疗的抗肿瘤效果。虽然肿瘤小鼠和正常小鼠体内CD19阳性胞外囊泡含有相近水平的CD39和CD73分子,并显示出类似的水解ATP和抑制化疗抗肿瘤效果的能力,但与正常小鼠相比,肿瘤小鼠的B细胞能够释放更多水平的胞外囊泡。进一步的研究表明,肿瘤微环境可上调B细胞中HIF-1ɑ的蛋白水平,随后HIF-1ɑ直接结合到Rab27a基因的启动子,促进Rab27a蛋白的表达,最终促进B细胞分泌更多的胞外囊泡。同样的,与健康人相比,该研究显示在不同分期的肿瘤病人血清中检测到更高水平的CD19阳性胞外囊泡,而且含有较低水平CD19阳性胞外囊泡病人显示出更好的化疗效果,进而提示了血清CD19阳性胞外囊泡在肿瘤诊断及化疗效果评价中的意义。
除此之外,为了进一步揭示CD19阳性胞外囊泡对化疗效果的影响,团队构了建B细胞特异缺失Rab27a基因的小鼠及肿瘤模型,在化疗后该小鼠体内CD8阳性T细胞活化程度明显增强,甚至有一半小鼠的肿瘤可以完全消失。为了将该发现与临床应用相联系,团队利用Epstein-Barr病毒(EBVs)特异感染人类B细胞的特性,将Rab27a小干扰RNA导入灭活的EBVs(Rab27a siRNA/iEBVs),利用Rab27a siRNA/iEBVs特异的抑制人源化NSG小鼠中人B细胞中Rab27a蛋白的表达,在人源化小鼠上构建肿瘤模型并得出:Rab27a siRNA/iEBVs能明显提高人源化小鼠化疗的效果,并增强人源化NSG小鼠中人CD8阳性T细胞的数量。
总的来说,该研究发现了由CD19阳性胞外囊泡介导的化疗后免疫抑制的新机制,并证实Rab27a siRNA/iEBVs与化疗联合的临床应用前景。
该工作主要由浙江大学医学院基础医学系蔡志坚教授和王建莉教授课题组完成,基础医学系博士生张方慧是论文第一作者,硕士生李荣荣及浙江省肿瘤医院杨云山医生是论文的共同第一作者,蔡志坚教授和王建莉教授是该论文的通讯作者。该课题受到到国家重点研发计划“蛋白质机器与生命过程调控”重点专项;国家“973”计划和国家自然科学基金的支持。
此文章转载浙江大学官网